Kapittel 3: Operasjonene som forsvant
Sykdommer i hjertet er den viktigste dødsårsaken i vår del av verden. I 1970-årene kom bypassoperasjonen, hvor brystbeinet sages opp og hjertet kobles til en hjerte-lunge-maskin før operasjonen begynner. Nå har vi enklere og bedre metoder som er langt mindre belastende for pasienten. Og utviklingen fortsetter.
I løpet av 1970-årene ble hjerteoperasjoner svært vanlig. Bare i Norge ble det utført over 5000 operasjoner årlig ved hjelp av hjerte-lunge-maskin. Den vanligste operasjonen var såkalt bypassoperasjon for tette kransarterier, der man koblet en åre fra hovedpulsåren forbi det trange stedet på kransarterien. En hjerteoperasjon er en stor operasjon der brystbenet sages opp og hjertet kobles på hjerte-lunge-maskinen før man kan stanse hjertet og begynne selve operasjonen. Selv om det postoperative forløpet kunne være tungt, var det verdt det for pasientene.
Figur 3.1 Utvikling av behandling av tette kransarterier i Norge. Bypasskirurgi (CABG), der kirurgene åpnet brystkassen og koblet hjertet på en hjerte-lunge-maskin før de sydde en åre forbi det trange stedet, var lenge eneste behandling for tette kransarterier, og i 2004 ble det utført 3430 slike operasjoner. I begynnelsen av 1980-årene begynte hjertemedisinerne å blokke opp det trange stedet med en ballong via en pulsåre i lysken eller armen (PCI). Denne behandlingen reduserte behovet for store hjerteoperasjoner. I 2016 ble det gjort 12 486 PCI-er, mens bare 1158 pasienter trengte operasjon.
I løpet av 1970-årene skjedde det en utvikling av røntgenutstyr og kontrastmidler, og legene begynte å behandle tette blodårer med å føre inn et kateter med en liten ballong som ble blåst opp der blodåren var trang. I 1979 kom den første artikkelen som beskrev denne teknikken brukt på tette kransarterier. I 1981 ble den første blokkingen av tette kransarterier utført i Norge. Metoden utviklet seg raskt, i starten som et supplement til bypassoperasjon, men etter hvert har metoden erstattet operasjon. I 2004 ble 3430 operert med bypassoperasjon i Norge, mens 11 269 pasienter ble behandlet med blokking av den trange åren. I 2016 ble det bare utført 1158 bypassoperasjoner, mens det ble utført 12 486 angioplastikker (figur 3.1).
De siste tiårene har vi fått røntgenveiledede metoder for å tette medfødte hull mellom kamrene i hjertet og etter hvert for å behandle tette hjerteklaffer. Det totale antallet hjerteoperasjoner i Norge har falt fra 5400 i 2004 til 4043 i 2015. Det er all grunn til å tro at dette tallet vil falle betydelig de neste to tre årene. Pasientene får en enklere behandling og kan reise hjem enten samme dag som de blir behandlet, eller dagen etter, og kan nesten umiddelbart gjenoppta sine vanlige gjøremål. Åpen operasjon krever ofte mer enn en ukes sykehusopphold, er forbundet med noe smerter og krever flere ukers rehabilitering.
Magesår
Magesår var en vanlig sykdom frem til 1980-årene. For de fleste var det en ubehagelig sykdom som kunne gi magesmerter og sure oppstøt, og man måtte passe på hva man spiste og drakk. Det var en teori om at sykdommen skyldtes for mye magesyre, og legene forordnet syrenøytraliserende. Hvis symptomene ble for plagsomme, kunne pasienter bli lagt inn på sykehus til en kur med såkalt skånekost som ikke irriterte såret.
Sårene kan være i magesekken eller øvre del av tolvfingertarmen. Noen pasienter fikk alvorlige symptomer, det verste var hvis såret gikk tvers igjennom magesekken og laget et hull – det var en livsfarlig situasjon. Da måtte pasienten opereres. En annen komplikasjon var at det ble for trangt i lukkemuskelen mellom magesekk og tolvfingertarm. Det var flere operasjonsmetoder. En metode var å fjerne store deler av magesekken og øvre del av tolvfingertarmen og koble den gjenværende delen direkte til tynntarmen.
Hvis det bare var for trangt kunne kirurgen utvide overgangen mellom magesekk og tolvfingertarm. Siden teorien om årsaken til sykdommen var at pasienten hadde for høy magesyreproduksjon, utviklet man et mindre inngrep der man skar over nerven som stimulerte magesekken – vagusnerven. Alt dette var vanlige operasjoner helt til de australske legene Barry Marshall og Robin Warrens oppdaget at magesår skyldtes en infeksjon med bakterien Helicobacter pylori. Nå behandles derfor begynnende magesår med antibiotika. Operasjon for magesår som ikke skyldes kreft, gjøres nesten ikke lenger.
Et viktig bidrag til oppdagelsen var utviklingen av gastroskopi, altså et fleksibelt skop som kunne føres ned gjennom spiserøret slik at legen kunne inspisere magesekken og øvre del av tolvfingertarmen, og kunne ta vevsprøver og bakterieprøver. Det var gjennom en slik undersøkelse bakteriene ble oppdaget.
Kikkhullskirurgi
Utviklingen av skop revolusjonerte ikke bare diagnostikken, men også behandlingen. I 1980-årene begynte gynekologer og kirurger å ta i bruk kikkhullskirurgi (figur 3.2). Det vil si at ved å lage flere mindre åpninger i huden kunne kirurgen føre inn et kamera og flere instrumenter. Det var takket være fiberoptikk og utviklingen av videoteknologi samt en rekke andre teknologiske fremskritt dette ble mulig. I 1987 ble den første galleoperasjonen i verden gjort med kikkhullsteknikk. Kikkhullskirurgien ble innført i Norge rundt 1990. Ti år senere, i 2000, ble nesten alle galleoperasjonene utført med kikkhullsteknikk. I dag utføres de fleste galleoperasjonene som dagkirurgi. Pasienten kommer til operasjon om morgenen og reiser hjem samme dag. I 1980- årene kunne pasienter operert for gallesten ligge en uke på sykehus.
Figur 3.2 Kikkhullskirurgi i 2018. Kirurgteamet ser på bilder overført fra kameraer inne i pasienten. På skjermen har de også røntgenbilder og annen informasjon om pasienten. Store operasjoner kan utføres med noen små snitt i huden.
I 1970-årene hadde ikke pasienter med tykktarmskreft som hadde spedd seg til leveren, noe behandlingstilbud. Det var i realiteten en dødsdom. Cellegift kunne forsinke utviklingen, men ikke kurere. I 1980-årene begynte man å operere bort de delene av leveren der det var spredning. Dette kunne redde noen pasienter, men operasjonene kunne føre til blødning og var farlig for pasienten. Etter hvert ble det utviklet utstyr som gjorde at man kunne skjære gjennom leveren uten store blødninger.
I 1992 ble den første operasjonen på lever utført med kikkhullskirurgi. Ved kikkhullskirurgi og moderne teknologi er i dag fjerning av deler av leveren et lite inngrep og ganske trygt. Kirurgisk fjerning og målrettet cellegiftbehandling har ført til at mange pasienter blir helt kurert for spredning av tykktarmskreft til leveren. Pasientene som blir operert med kikkhullsteknikk, kan møte fastende til operasjon om morgenen og trenger ofte bare å være på sykehuset en natt til observasjon etter operasjonen.
Roboter
Mange funksjoner i sykehus er blitt gradvis automatisert og robotisert de siste tiårene. Flere blodprøveanalyser er i dag automatisert. Røntgenutstyret kan styres av robotteknologi. Portørtjenesten blir gradvis erstattet av transportroboter som frakter varer rundt i sykehusene. I slutten av 1990-årene kom de første operasjonsrobotene på markedet, og operasjon med robot har gradvis blitt en rutine, spesielt ved fjerning av prostata ved tidlig prostatakreft.
Operasjonsrobotene er foreløpig ikke maskiner som utfører arbeid selvstendig, slik vi vanligvis forbinder med roboter, men systemer som overfører kirurgens bevegelser til små instrumenter som er festet på armer inn i kroppen. I dag er det hovedsakelig ett system på markedet. Kirurgen sitter ved siden av pasienten og ser inn i roboten. Der har han tredimensjonalt syn fordi det er to skjermer og to kameraer, og han styrer instrumentene inne i pasienten ved å bevege fingrene.
Det er enklere å operere med roboten enn med vanlig kikkhullskirurgi, men det er dyrere. Roboten koster ca. 20 millioner kroner, og engangsutstyret er dyrt. Det har derfor vært vanskelig å dokumentere at robotkirurgi er kostnadseffektivt. Robotkirurgi er mest utbredt ved fjerning av prostatakjertelen hos menn, men bruken øker også ved andre inngrep, både gynekologiske og kirurgiske.
Digitaliseringen av helsevesenet
I 1970-årene begynte digitaliseringen av helsevesenet for alvor. Databehandling ga legene mulighet til fortløpende å registrere pasientene og hvordan det gikk med dem. Slike registre førte til at det var lettere å oppdage uønskede hendelser og også at ressursene kunne brukes mer målrettet. Dette bedret kvaliteten på behandlingen.
Digitaliseringen førte også til helt nye undersøkelsesmetoder. Den første såkalte computertomografen (CT) ble utviklet i 1970-årene. I en CT-maskin kommer røntgenstrålene inn i kroppen fra mange ulike vinkler. De fanges ikke opp av film, men av en stråledetektor som et mønster av elektriske impulser, og disse bruker computeren til å rekonstruere et tverrsnittsbilde. Ved å ta mange tverrsnittsbilder kan computeren sette dem sammen til et tredimensjonalt røntgenbilde av pasienten.
Ulempen med CT var at man måtte utsette pasienten for ganske mye røntgenstråling for å få et bilde, og undersøkelsen tok tid. Mot slutten av 1990-årene begynte man å integrere flere detektorer i samme CT-maskin. Dette førte til at stråledosen kunne reduseres, og man kunne fremstille bilder på mye kortere tid. I dag påfører en CT-scanning av hele kroppen ikke særlig mer strålebelastning enn ett enkelt skjermbilde gjorde for 15 år siden.
Digitaliseringen banet også veien for en annen avansert avbildningsmetode: magnetresonanstomografen (MR). MR er ikke basert på røntgenstråler. Bildet lages ved at pasienten ligger inne i et kraftig magnetfelt, og så bombarderes den delen av kroppen man skal avbilde, med radiobølger. Antenner plassert på pasienten, fanger opp signalene som oppstår. Da kan man få et bilde som viser bløte organer veldig bra. Men undersøkelsen tar noe lenger tid enn en CT. Det er derfor vanskeligere å avbilde organer som beveger seg.
MR har imidlertid mange andre fortrinn. Undersøkelsen kan fange opp endringer i oksygenkonsentrasjon i blodet. Dette er bakgrunnen for såkalt funksjonell MR. Ved å undersøke hjernen med en slik funksjon kan man identifisere områder med mest oksygenforbruk. Dette brukes mye til å kartlegge hvor i hjernen ulike funksjoner som hukommelse, stress, smerte, talesentre og andre sentre er. En annen spesialundersøkelse med MR kan fremstille områder i vevet der det er mer blodårer enn vanlig, dette er ofte et tegn på en ondartet svulst. Det er viktig at MR ikke bruker radioaktiv stråling. Helserisikoen er derfor mye mindre enn med utstyr som bruker røntgenstråler.
I dag er alt røntgenutstyr digitalisert. Det vil si at bildeopptaket bare er en digital kode. Maskinen gjør så denne koden om til et bilde som røntgenlegen kan tolke. Siden røntgenlegen bruker skjønn, kreves det at to radiologer vurderer bildene før røntgenavdelingen kan sende ut et svar. Siden computere i dag kan behandle store datamengder og datamaskinen kan lære ved å gjenkjenne mønstre og utsagn, kan man koble dataprogram til bildeutstyret, slik at maskinen selv kan tolke undersøkelsen.
De siste årene har det kommet flere dataprogrammer for slik tolkning av undersøkelser. Etter som kunstig intelligens og behandling av store datamengder har blitt enklere og billigere, er det sannsynlig at det radiologiske utstyret selv vil kunne tolke undersøkelsen med stor nøyaktighet. Da vil det klare seg med bare en radiolog til å kontrollere maskinens analyse. Samtidig blir bildefysikernes rolle viktigere. De må kontrollere at algoritmene i utstyret fungerer som de skal.
Virtuell virkelighet inn på operasjonsstuen
Automatisk analyse er bare en av konsekvensene av forbedret datateknologi. I dag kan datamaskinen læres opp til å vurdere mange avbildningsteknikker samtidig, for eksempel funksjonell undersøkelse sammen med utvikling av blodgjennomstrømning og de anatomiske bildene. Ved å gjøre slike analyser over tid kan vi overvåke utviklingen av en kreftsvulst og se hvordan den svarer på behandling. Denne nye metoden for å bruke flere avbildningsmetoder ved å koble dem sammen ved hjelp av et analyseverktøy kalles radiomikk. Ved å koble annen informasjon, for eksempel blodprøvesvar, til bildeanalysene kan vi etter hvert få veldig nøyaktig informasjon om sykdomsutviklingen.
Ved kikkhullskirurgi ser kirurgen overflaten av alle organene ved hjelp av et kamera. Hvis han skal operere et organ som leveren eller lungen, kan det være en fordel å også se blodårene inne i leveren under operasjonen. Ved å hente CT-bilder tatt før operasjonen og bearbeide dem slik at alle blodårene kommer klart frem, kan dette kartet over blodårer enten kobles sammen med videoskjermen kirurgen ser på, eller vises ved siden av på en egen skjerm. Kirurgen får da det som kalles «augmented reality». Dette har vist seg å gi mer nøyaktig kirurgi. Innen nevrokirurgien brukes i dag navigasjon i radiologiske bilder rutinemessig, siden de ikke kan lage store snitt i hjernen for å se. I dag bruker vi stadig oftere kopier av organet fremstilt på en 3D-printer (figur 3.3abc), eller vi kan planlegge operasjonen ved hjelp av et hologram ved å bruke spesielle briller (figur 3.4).
Figur 3.3 Fremstilling av en kopi av et hjerte hos et barn med medfødt hjertefeil.
a. Det tas et CT- eller MR-bilde av hjertet.
b. I computeren settes alle bildesnittene sammen til et tredimensjonalt bilde.
c. Ved hjelp av et spesielt dataprogram kan det tredimensjonale bildet fra computeren legges inn i en 3D-printer som produserer en eksakt kopi av hjertet i plast. Denne kopien kan kirurgene se på mens de planlegger operasjonen. De kan også skjære i kopien og øve på selve operasjonen.
Figur 3.4 Hololens fra Sopra Steria. Legene kan få overført de tredimensjonale bildene til en liten datamaskin som er inne i brillen. Brillen lager et hologram slik at legen får inntrykk av å være inne i kroppen og han kan rotere organet gå inn i lokalet og planlegge operasjonen. Dette er en billigere teknikk enn å printe organet. Kirurgen kan også bruke brillene mens han opererer og da se både inn i pasienten og ha det tredimensjonale MR- eller CT-bildet på skjermen. Dette kalles augmented reality.
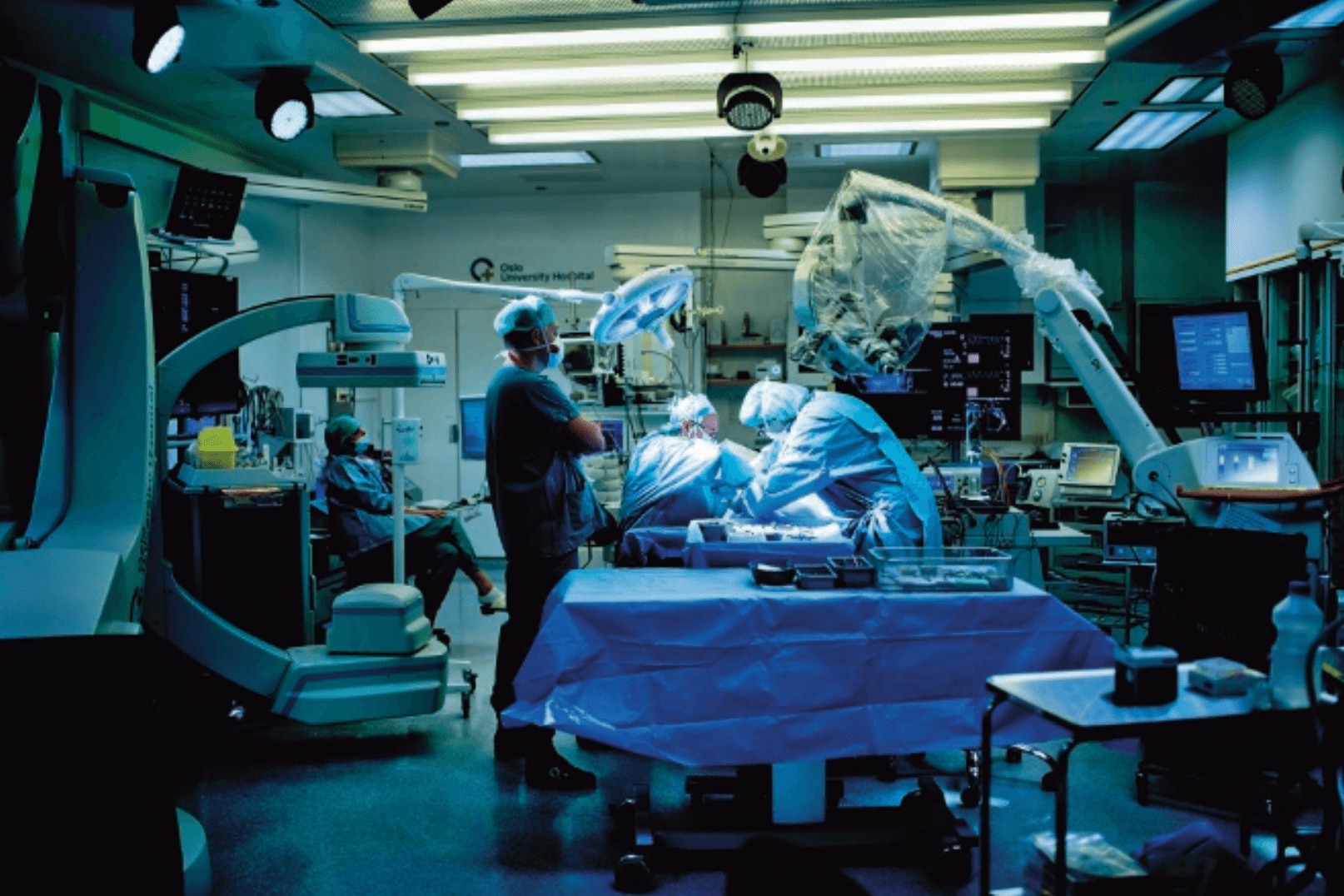
Når sykehusene tar i bruk det samme avanserte radiologiske utstyret i behandlingen av pasientene som det vi bruker til diagnostikk i røntgenavdelingene, kan det gi nye muligheter for raskere og bedre behandling. Ved flere sykehus bygges det nå såkalte intervensjonssentere der operasjonsrom kombineres med MR-utstyr, CT-utstyr og avansert røntgenutstyr integrert i rommene (figur 3.5). Denne kombinasjonen av utstyr gjør det mulig å utføre store operasjoner gjennom små snitt. Det avanserte avbildningsutstyret sammen med videoteknikker gjør at kirurgene kan utføre svært presise inngrep, der de har mye mer informasjon enn ved vanlige operasjoner.
Figur 3.5 MR-undersøkelse under operasjon i hjernen. Pasienten fraktes inn i MR under en operasjon i hjernen ved Intervensjonssenterets operasjonsstuer på Rikshospitalet. Til høyre i bildet ses nevrokirurgens operasjonsmikroskop.
Ved å samle utstyr og bruke det både til diagnostikk og behandling blir det mulig å i større grad behandle pasientene med en gang man finner noe galt (figur 3.6). En annen viktig grunn til å samle drift av utstyrskrevende behandlingsrom i én avdeling er at bildeutstyret er kostbart, og siden alt bildeutstyr i dag er datamaskiner, blir de like fort utdatert som en PC, uansett om de kan koste 15–20 millioner kroner. Helsevesenet tvinges derfor til i større grad å ta hensyn til at behandlinger kan bli hindret av teknologisk svikt, og at utstyr må avskrives i løpet av 5–10 år og skiftes ut regelmessig.
Figur 3.6 Hjerteoperasjon i hybridrom på Intervensjonssenteret, der det kan utføres avanserte operasjoner ved hjelp av røntgenutstyr. Siemens har utviklet operasjonsstuer der vi både kan bruke CT, MR og avansert røntgenutstyr sammen med kikkhullsinstrumenter. I dag har alle nye sykehus slike stuer, og dette blir nok den vanlige utformingen på fremtidens operasjonsrom.
Genetikk
I 1980-årene klarte forskere å analysere hele det menneskelige arvestoffet – DNA-et. DNA finnes i cellekjernene i alle cellene i kroppen og inneholder en kode som bestemmer hvordan en celle skal utvikle seg, og hvilke oppgaver den skal løse. DNA er to kjeder bestående av baser som er knyttet sammen i basepar, basene er sammensatt av fire ulike basepar, adenin, guanin, cytosin og tymin. Rekkefølgen av baseparene utgjør den genetiske koden – gensekvensen. DNA består av 3,2 milliarder basepar.
DNA-et er fordelt på 23 par kromosomer som er omsluttet av proteiner som kalles histoner. Det er histonene som regulerer hvilken del av DNA-et som er aktivt. Histonene frigjør ulike deler av DNA-et avhengig av hvilken funksjon cellen skal ha. Dette gjør at det samme DNA-et kan utvikle celler med helt ulike egenskaper. DNA-tråden koder ikke bare ved hjelp av genskvensene. For eksempel har også plasseringen av et gen i rommet betydning for hvordan det leses av og reguleres. DNAkoden er derfor komplisert og krevende å knekke.
Oppdagelsen av DNA-koden og hvordan den virker, førte til en eksplosiv utvikling i forståelsen av grunnleggende biologiske mekanismer. Det er utviklet metoder og teknologi for å kunne lese av DNA-sekvenser og etter hvert hele arvematerialet eller genomet til mennesker, dyr og pasientgrupper. Det humane genomet ble for første gang sekvensert i et stort prosjekt som ble fullført i 2003. I dag er DNA-sekvensering nærmest blitt rutine.
Testing av en pasients DNA kan si noe om hvilke sykdommer man er disponert for. Det finnes arvelige sykdommer som man vil utvikle så lenge man har bestemte gensekvenser, men dette er sjeldent. Veldig ofte kan gensekvensene disponere for sykdom, men det kan også være andre faktorer som spiller inn. Ved å koble geninformasjon til andre undersøkelser av pasienten kan man derfor raskere finne diagnoser. Gensekvensering av kreftsvulster har gitt opphav til helt nye medisiner for behandling av kreft. Ved å gensekvensere bakterier kan vi finne ut mer om hvilke medikamenter som virker best på dem. I 2019 er vi bare i startfasen av å utnytte de mulighetene analyse av genene kan gi.
I dag gir legen medisiner ut fra erfaring om hvilke medisiner som pleier å virke på den enkelte sykdommen. Doseringen står oppført i Felleskatalogen og er den samme for alle med samme alder eller samme vekt. Ny forskning viser at det er store individuelle forskjeller mellom mennesker når det gjelder å forbrenne og nyttiggjøre seg medisinen. Det er også store individuelle forskjeller i hvor godt man tåler medisinen uten å få bivirkninger. Denne individuelle reaksjonen på medisiner kan bli enda mer uttalt hvis pasientene tar mange forskjellige medisiner samtidig. Da kan medikamenter forsterke eller oppheve virkningen av hverandre, eller også forsterke bivirkningene.
Ved gentesting kan vi forutsi individuelle evner til å nyttiggjøre seg medikamentet og risikoen for bivirkninger. Kunnskapen om dette øker for hver dag. Food and Drug Administration i USA har våren 2017 mer enn 200 medikamenter på en liste der de anbefaler gentesting før legen foreskriver medikamenter. Mange av medikamentene på listen har vært brukt i mange år i standardiserte doseringer til alle pasienter. Foreløpig er gentesting dyrt og tidkrevende, men både tid og kostnader blir mindre etter hvert som teknologien utvikles. Alt tyder på at en kartlegging av alle menneskers gener vil gjøre medisinering tryggere og billigere.
Kunstig intelligens og stordata
En viktig fordel ved at alle data om pasienten er digitale, er at den samme informasjonen kan gjøres tilgjengelig for helsepersonell ved forskjellige sykehus og legekontor. Norske myndigheter arbeider med et prosjekt kalt «En innbygger – en journal» og samtidig det som kalles helsenett– en sikker nettverksløsning der personlige data kan sendes uten å komme på avveie. På sikt vil alle innbyggere ha én journal hele livet. Uansett hvilket sykehus eller legekontor pasienten oppsøker, vil helsepersonellet kunne hente opp den samme journalen. Dermed kan vi sikre at all relevant informasjon er tilgjengelig hvis pasienten må behandles.
Den raske utviklingen i diagnostikk og behandlingsmuligheter har i løpet av kort tid ført til store endringer i måten vi arbeider på i helsetjenesten. Tidligere var behandlingen begrenset av vår mulighet til å få nok informasjon om pasienten og sykdommen. Nå er dette snudd på hodet. I dag er utfordringen å gjøre mangfoldet av data tilgjengelig, og legge til rette for at dataene blir tolket og analysert riktig.
Den moderne avbildningsteknologien og genanalysene kan gi store datamengder som gir en omfattende og detaljert profil av hver pasient og sykdommen hennes. Siden dataene involverer veldig spesialisert informasjon, blir beslutninger om diagnostikk og behandling tatt av tverrfaglige team som har kompetanse om de ulike typer data. Denne prosessen kan overtas av datasystemer som kan strukturere, knytte sammen og analysere all tilgjengelig informasjon om pasienten. Vi kan dermed få mange flere detaljer som kan ha betydning for behandlingen.
Betegnelsen presisjonsmedisin eller persontilpasset medisin er brukt om det å bruke genetisk og bildedata på denne måten, men utviklingen frem mot klinisk bruk har gått svært langsomt. Det skyldes to ting: Utviklingen i bruk av geninformasjon til klinisk brukt har vært mye vanskeligere enn man har trodd, og datamengdene som må analyseres er så store at legene ikke klarer å utnytte og tolke alle dataene korrekt.
I 2017 startet Oslo universitetssykehus derfor et stort prosjekt – BIGMED der målet er å utvikle helt nye konsepter for digital behandling av pasientdokumentasjon og digital beslutningsstøtte. Selv om alle pasientjournaler og alle blodprøver og røntgensvar lagres digitalt, bruker vi dataene som om de var på papir: Helsepersonellet henter dataene fra den enkelte pasient, skriver inn nye data og legger journalen tilbake i lageret.
BIGMED-løsningen kombinerer nyvinninger i bioinformatikk (digital behandling av genetiske data) og nye systemer som kan lese ustrukturert journaltekst og overføre innholdet til logiske beslutninger. Det betyr at datamaskinen kan læres opp til å analysere data på egen hånd, og kan kombinere flere sammenhenger mellom data jo mer data den får inn.
På sikt håper vi at datamaskinen kjenner igjen en syke historie til en ny pasient og sammenlikner med alle de tusenvis av journalene som allerede ligger i systemet. Hvis den i tillegg leser alle nye vitenskapelige artikler som kommer og husker dem, kan datamaskinen gi legene råd om hvordan de skal behandle pasienten.
E-helse - helse på internett
Bruk av nettet og smarttelefoner har tatt helt av, og vi får stadige nye apper som kan løse større eller mindre problemer. Mange av løsningene som i dag finnes i mobiltelefonene, kan brukes til helse og velferd. En rekke sensorer kan i dag plasseres i hjemmene eller på en pasient, slik at pasienten kan overvåkes.
Trygghetsalarmer der pasienten selv slår alarm har eksistert lenge. Hjem kan også utstyres med sensorer som slår alarm hvis det ikke er noen bevegelser i rommet over tid. Flere kommuner bruker i dag GPS som gis til pasienter med demens. De kan dermed bevege seg fritt innenfor et visst område. Hvis de beveger seg utenfor området, slås det alarm.
Sykehuset hjem til pasienten
Firmaet Dignio har sammen med flere bydeler i Oslo kommune og andre kommuner prøvd ut medisinske sensorer som pasientene kan bruke selv hjemme. Det gjelder blodsukkersensorer, blodtrykkssensor, spiro meter for pasienter med kols eller astma, termometer og vekt og en pilledispenser. Pasientene utfører selv målingene og sender dem til en sentral bemannet av sykepleiere som kan overvåke forandringer over tid. Pasientene føler trygghet med en slik løsning, og det viser seg at behovet for kontroller hos lege går ned.
Men dette er nok bare begynnelsen på en helt ny måte å drive helseovervåking på. Ved automatisering av analysene og datamaskiner som kan håndtere store datamengder, kan man tenke seg at pasienter får med seg en sensor som sender kontinuerlig informasjon til en datamaskin som knytter sensordata til pasientens journal og diagnose. Systemet kan da slå alarm hvis sensor målingene går utenfor et referanseområde.
På sikt kommer nok også sensorer som kan opereres inn i pasientene og kobles til medisinpumper som frigjør medisiner i kroppen ut fra hva sensoren måler. Ved sukkersyke forskes det mye på blodsukkersensorer koblet til en pumpe som automatisk gir insulin hvis pasientens blodsukker blir for høyt. Men slike autonome systemer ligger nok et stykke inn i fremtiden. Det kan være farlig hvis sensoren måler feil og pasienten får en for høy dose insulin. Da kan pasienten være i livsfare. Ingen systemer har i dag den nødvendige sikkerheten til å brukes på denne måten.
Medaljens bakside
Mulighetene for å samle pasientdata i registre og til å overføre data mellom sykehus utfordrer pasientenes sikkerhet. Svært personlige opplysninger kan komme på avveie. Dette er spesielt utfordrende dersom genetisk informasjon skal brukes. Den eneste metoden for å tolke den genetiske koden, og forstå hva de gensekvensene man finner, egentlig betyr, er å sammenlikne informasjonen med genetisk materiale fra mange andre pasienter. Utfordringen med å gjøre dette er at genmaterialet til en pasient er like identifiserende som et fingeravtrykk. Det blir et problem å samtidig skjule pasientens identitet.
I dag bruker helsevesenet store summer på datasikkerhet, og samtidig avdekkes det situasjoner der pasientinformasjon er kommet på avveie. Dette var ikke et problem da pasientinformasjonen bare fantes i papirformat og ble holdt innelåst i et lager, og da det var vanskelig å koble pasientdata fra ulike undersøkelser. Bruk av internett og interaktive løsninger på nettet endrer nok folks forståelse av privatliv og spesielt hvilke opp - lysninger som er private og hvilke som ikke er det. Vi lever i en tid der de teknologiske mulighetene ut - vikles raskt, og det samme gjør folks holdninger. Lov - verket er derimot skrevet for flere år siden, med en annen teknologisk virkelighet. Alle de medisinske mu - lighetene som ligger i teknologiutviklingen, må derfor ledsages av juridisk forskning, slik at vi sikrer at pasien - tene får tilgang på nye behandlingsmuligheter, samtidig som personvernet og andre rettigheter respekteres.
Mer som dette
Nyhetsbrev
Nobelprisvinner og æresmedlem Ivar Giæver er død
Nobelprisvinner, æresdoktor ved NTH og NTVAs æresmedlem Ivar Giæver døde 20. juni i Schenectady i...
NTVAs ærespris for 2024 tildeles Jarl Gjønnes og...
Får ærespris for utvikling av banebrytende teknologi for å rasjonalisere høsting og ta bedre vare...
Artikler
Farvel, bærekraft?
Tomas Moe Skjølsvolds artikkel "Farvel, bærekraft?" i festskriftet utforsker hvorfor håpet om en...
Står teknologi i motsetning til natur?
Naturens økosystemer er blant de mest komplekse systemene på jorden, med millioner av livsformer...
Publikasjoner
Festskrift Helge Brattebø
Denne boken er et festskrift til professor Helge Brattebø, utgitt av NTNU og NTVA. Den hyller...
Natur og teknologi
I Norge har vi forpliktet oss til å verne store deler av norsk natur, samtidig som det er planer om...
Teknologien endrer samfunnet
Teknologi endrer samfunn, noe som knapt nok er en nyhet. Om vi betrakter alt som er oppfunnet...
Arrangementer
Hvilke klimamål bør Norge ha? – Innsikt fra...
Norges klimamål: Innsikt og debatt. NTVA inviterer til viktig arrangement med presentasjon fra...
Når kommer toget?
Slik får vi jernbanen på skinner igjen....
Balansekunst i kraftsystemet: Når samfunnets...
Energi er grunnlaget for alt i vårt moderne samfunn, fra lys og varme i hjemmet til industri og...